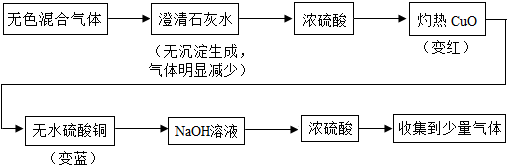
某无色混合气体可能含有H2、CO、HCl、CO2、N2中的几种。现将该气体经下图程序处理(假设每种反应均完全),请判断下列说法正确的是( )
- A.原混合气体中一定含有HCl气体,一定不含CO2
- B.原混合气体中一定含有H2和CO
- C.混合气体的成分可能是H2、CO、HCl、CO2
- D.混合气体的成分可能是H2、CO、HCl、CO2、N2
答案
正确答案:D
知识点:气体的检验和鉴别
澄清石灰水能够吸收HCl和CO2,浓硫酸吸收水分,氧化铜变红说明有还原性气体,无水硫酸铜变蓝说明前一步有水生成,NaOH溶液吸收CO2。
根据图中的现象分析,通过澄清石灰水时无沉淀生成且气体量明显减少,则说明混合气体中一定含有HCl,分为下列两种情况:①含有HCl气体;②含有大量的HCl和一定量CO2,此时澄清石灰水只吸收了大量的HCl就已用完,CO2并未参与反应,所以通过澄清石灰水时无沉淀生成且气体量明显减少。浓硫酸除去水分后的混合气体通过灼热的CuO变红,且之后通过无水硫酸铜变蓝,说明混合气体中一定含有H2,而CO可能存在。NaOH溶液吸收CO2,浓硫酸吸收水分,反应后仍收集到少量气体,则只能是N2,说明混合气体中一定含有N2。综上,混合气体中一定含有HCl、H2和N2,可能含有CO和CO2。故选D。
略








