一定质量的镁和锌与等质量、等溶质质量分数的盐酸反应,下列关系图中,纵坐标表示产生氢气的质量,横坐标表示时间,正确的是( )
- A.
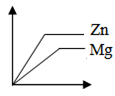
- B.
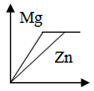
- C.
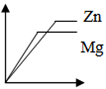
- D.
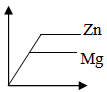
答案
正确答案:B
知识点:金属与酸的反应
金属与酸反应时,金属活动性越强,图象斜率越大,产生氢气越快。
Zn、Mg两种金属的活动性顺序为Mg>Zn,则图象中斜率关系为Mg>Zn,故A、D错误。
(1)假设相同质量的Zn、Mg与足量的酸反应。
相同质量的金属与足量的酸反应,产生氢气的多少由金属决定。设生成物中金属元素化合价为+a,已知金属的质量为m,金属的相对原子质量为Ar,金属与盐酸反应通式可表示为2R+2aHCl=2RCla+aH2↑,则产生氢气的质量为![]() 。一般情况下,生成物中金属元素常显+2价,相同质量的金属参加反应,则金属的相对原子质量越小,产生氢气的质量越大。Zn的相对分子质量为65,Mg的相对分子质量为24,Ar(Zn)>Ar(Mg),则等质量的Zn和Mg分别与足量的盐酸反应,Mg产生的氢气质量大于Zn。故C错误。
。一般情况下,生成物中金属元素常显+2价,相同质量的金属参加反应,则金属的相对原子质量越小,产生氢气的质量越大。Zn的相对分子质量为65,Mg的相对分子质量为24,Ar(Zn)>Ar(Mg),则等质量的Zn和Mg分别与足量的盐酸反应,Mg产生的氢气质量大于Zn。故C错误。
(2)假设足量的Zn、Mg与等量的酸反应。
足量的金属与等质量、等溶质质量分数的同种酸反应,产生氢气的多少由酸决定,根据金属与盐酸反应通式2R+2aHCl=2RCla+aH2↑可知,产生氢气的量相同。故B正确。
故选B。
略







