某同学将Mg和金属X的混合物共2.4 g加入足量的稀硫酸,充分反应后得到0.22gH2,则金属X可能是( )
- A.Fe
- B.Zn
- C.Al
- D.Cu
答案
正确答案:C
知识点:金属与酸的反应
根据金属混合物质量、氢气质量以及氢气的相对分子质量,计算出金属混合物的平均相对原子质量,进而用平均值法,推测金属混合物的成分。
设金属与酸反应生成物中金属元素化合价为+a,已知金属的质量为m,金属的相对原子质量为Ar,则产生氢气的质量为![]() 。一般情况下,生成物中金属元素常显+2价,产生氢气的质量为
。一般情况下,生成物中金属元素常显+2价,产生氢气的质量为![]() (常见的+2价金属的有Mg、Fe、Zn,产生的氢气质量分别为
(常见的+2价金属的有Mg、Fe、Zn,产生的氢气质量分别为![]() 、
、![]() 、
、![]() ),相同质量的金属参加反应,则金属的相对原子质量越小,产生氢气的质量越大。对于金属Al(在生成物中通常显+3价),产生氢气的质量为
),相同质量的金属参加反应,则金属的相对原子质量越小,产生氢气的质量越大。对于金属Al(在生成物中通常显+3价),产生氢气的质量为![]() ,等质量的Al与等质量的+2价金属(常见的+2价金属的有Mg、Fe、Zn,产生的氢气质量分别为
,等质量的Al与等质量的+2价金属(常见的+2价金属的有Mg、Fe、Zn,产生的氢气质量分别为![]() 、
、![]() 、
、![]() )相比,产生氢气的质量最多。
)相比,产生氢气的质量最多。
设混合物中两种金属的平均相对原子质量为![]() ,且两种金属与稀硫酸反应后,在生成物中均为+2价。则
,且两种金属与稀硫酸反应后,在生成物中均为+2价。则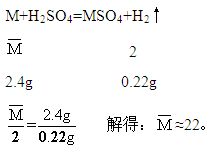
即两种金属的相对原子质量一个要大于22,一个要小于22;或者一种金属要比等质量的金属M产生氢气的质量多,另一种金属要比等质量的金属M产生氢气的质量少。
Zn(65)的相对原子质量大于60,比等质量的金属M产生氢气的质量少,故另一种金属的相对原子质量小于60或比等质量的金属M产生氢气的质量多。
Fe(56)相对原子质量大于22,比等质量的金属M(22)产生氢气的质量少;
Zn(65)相对原子质量大于22,比等质量的金属M(22)产生氢气的质量少;
Al比等质量的任何+2价金属产生氢气的质量都多;
Cu不与硫酸反应,可视为比等质量的金属M产生氢气的质量少。
故选C。
略







