如图是某兴趣小组设计的测定样品中CuO质量分数的实验装置图,请回答问题:

(1)实验开始时,先通入一会儿H2再加热的原因是 。
(2)实验结束时,撤去酒精灯后还要通H2的目的是 。
(3)A装置的作用是 ;D装置的作用是 。
(4)若取10g样品做实验,实验结束后发现C装置增重了1.8g。
①通入该装置的H2质量肯定 0.2g(填“>”、“<”或“=”)。
②样品中CuO的质量分数为 。
答案
(1)先排出装置内的空气。
(2)防止生成的Cu被重新氧化。
(3)干燥H2或除去H2中的水蒸气;防止空气中的H2O进入C装置。
(4)①>;②80%。
知识点:还原性物质相关实验
氢气和氧化铜发生反应的化学方程式为CuO+H2![]() Cu+H2O。分析题意,可根据C中增加的H2O的质量计算CuO的质量,进而求出样品中CuO的质量分数。
Cu+H2O。分析题意,可根据C中增加的H2O的质量计算CuO的质量,进而求出样品中CuO的质量分数。
(1)实验开始时,先通入一会儿H2再加热的原因是先排出装置内的空气。
(2)实验结束时,撤去酒精灯后还要通H2的目的是防止生成的Cu被重新氧化。
(3)进入B装置的H2需要干燥,A装置中盛有浓硫酸,其作用是干燥H2或除去H2中的水蒸气;实验是通过测定C装置中增加的质量来确定生成的H2O的质量,所以应排除空气中水蒸气的干扰,D装置中盛有干燥剂,其作用是防止空气中的水蒸气进入C装置。
(4)C装置增重了1.8g,则生成的H2O的质量是1.8g,设样品中CuO的质量为x,需要H2的质量为y。
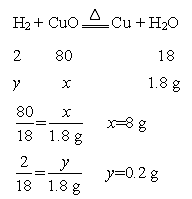
故混合物中氧化铜的质量分数为![]() 。
。
因为反应开始前和反应结束后均需提前通一会儿H2,所以通入该装置的H2质量肯定大于0.2g。
略








