向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是( )
- A.
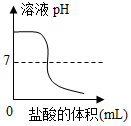
- B.
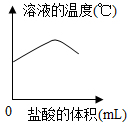
- C.
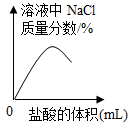
- D.
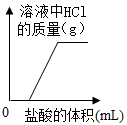
答案
正确答案:D
氢氧化钠溶液中逐滴加入稀盐酸,发生反应的方程式为NaOH+HCl![]() NaCl+H2O。
NaCl+H2O。
A.刚开始为氢氧化钠溶液,显碱性,随着盐酸的加入,盐酸与氢氧化钠反应逐渐把氢氧化钠消耗掉生成中性的氯化钠,因此pH逐渐减小直至氢氧化钠被反应完,全部为氯化钠,此时溶液显中性,继续滴加盐酸,盐酸过量,溶液显酸性,且随着盐酸的加入,酸性增强,pH继续减小,A正确;
B.酸碱中和反应为放热反应,随着盐酸的加入,反应放出热量,温度升高,氢氧化钠与盐酸恰好完反应时放出的热量最多,温度最高,继续加入盐酸,温度降低,直至降低至原来的温度,B正确;
C.刚开始溶液中氯化钠的质量分数为0,随着盐酸的加入,盐酸与氢氧化钠反应生成氯化钠,氯化钠的质量分数逐渐增大,当氢氧化钠与盐酸恰好完全反应时氯化钠的质量分数达到最大,再加入稀盐酸,溶液的质量逐渐增大,氯化钠的质量不变,氯化钠的质量分数逐渐减小,C正确;
D.当溶液中的氢氧化钠未反应完时,溶液中HCl的质量为0,当氢氧化钠与盐酸恰好完全反应时,继续滴加盐酸,溶液中HCl的质量随着加入盐酸的量的增大而逐渐增大,D错误。
故选D。
略







