二甲醚是一种应用前景广阔的清洁燃料。4.6g二甲醚完全燃烧,生成8.8g二氧化碳和5.4g水,下列判断不正确的是( )
- A.4.6g二甲醚完全燃烧消耗9.6g氧气
- B.二甲醚由碳、氢两种元素组成
- C.二甲醚中碳、氢元素的质量比为4:1
- D.二甲醚中氢元素的质量分数为13%
答案
正确答案:B
知识点:元素种类和质量守恒
题干给出部分组成已知的物质质量,让判断组成未知物质的相关信
息。此类题目,需根据元素的种类和质量守恒来解答。
用X表示二甲醚,根据题意,该反应可表示为:
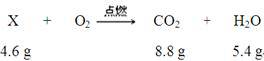
A.由质量守恒定律,4.6g二甲醚完全燃烧消耗氧气的质量为8.8g+5.4g-4.6g=9.6g,故A正确。
B.由质量守恒定律,反应前后元素种类和质量不变,二甲醚中一定有碳元素和氢元素,且碳元素的质量等于8.8gCO2中碳元素的质量:
8.8g×![]() ×100%=2.4g,氢元素的质量等于5.4gH2O中氢元素的质量:
×100%=2.4g,氢元素的质量等于5.4gH2O中氢元素的质量:
5.4 g×![]() ×100% = 0.6 g。碳、氢元素质量之和为2.4g+0.6g=3g<4.6g,所以二甲醚中一定还含有氧元素,故B错误。
×100% = 0.6 g。碳、氢元素质量之和为2.4g+0.6g=3g<4.6g,所以二甲醚中一定还含有氧元素,故B错误。
C.由以上分析可知,二甲醚中碳、氢元素的质量分别为2.4g、0.6g,则二甲醚中碳、氢元素的质量比为2.4g: 0.6g=4:1,故C正确。
D.由以上分析可知,二甲醚中氢元素的质量为0.6g,二甲醚的质量为4.6g,则二甲醚中氢元素的质量分数:![]() ×100%≈13%,故D正确。
×100%≈13%,故D正确。
故选B。
略







