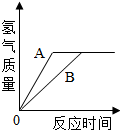
- A.产生氢气的速率A<B
- B.反应后A、B一定都有剩余
- C.消耗的稀硫酸和稀盐酸质量一定不相等
- D.消耗B的质量一定小于A的质量
答案
正确答案:C
知识点:金属与酸的反应
A.产生氢气的速率与坐标图象中直线的斜率有关,斜率越大,速率越快,A的斜率大于B,故A的速率较快,A错误;
B.产生的氢气相等,因此可判断酸不足,故反应后A、B可能都有剩余,也可能是一种反应完,一种剩余,B错误;
C.产生的H2质量相等,那么消耗的H+的质量相等,因为H2SO4和HCl的相对分子质量不相等,因此H2SO4和HCl质量一定不相等,C正确;
D.在反应中A、B均为+2价,故产生的H2越多,金属的相对原子质量越小,如果产生相同质量的H2,则相对原子质量小的金属消耗的比较少,由于Ar(A)
略








