向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液,反应过程中
加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法正确的是( )

- A.图中0—a段表示生成沉淀的过程
- B.c点溶液中溶质有2种
- C.d点溶液的pH>7
- D.b点时消耗Na2CO3的质量为106.0g
答案
正确答案:C
知识点:物质间的反应
加入的Na2CO3先与HCl反应,把HCl消耗完了,才开始与CaCl2反应,开始生成
沉淀。如果先与CaCl2反应生成CaCO3沉淀,则沉淀又和HCl反应生成了CaCl2,
故该顺序不成立。
分析图象可知,0—a段表示Na2CO3和HCl反应生成CO2的过程,到达a点将HCl
消耗完。b—c段表示Na2CO3和CaCl2反应生成CaCO3沉淀的过程,到达c点将
CaCl消耗完。c—d段加入Na2CO3不再发生反应。
A.由分析可知A错误;
B.达到c点恰好将CaCl2消耗完,生成了CaCO3沉淀和NaCl,故溶液中溶质只有
1种为NaCl,B错误;
C.d点时加入的Na2CO3不再发生反应,溶液中的溶质为NaCl和Na2CO3,故溶液
显碱性,pH>7,C正确;
D.0—a段表示Na2CO3和HCl反应生成CO2的过程,故产生的CO2的质量为2.2 g,
设消耗的Na2CO3的质量为x,则
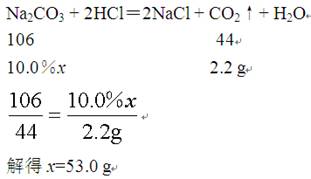
b点恰好将HCl消耗完,故消耗的Na2CO3的质量为53.0 g,D错误。
故选C。
略








