侯氏制碱法制得的纯碱中通常含有少量的氯化钠。现有含氯化钠杂质的纯碱样品22.8g,全部溶解在350g水中。向溶液中加入氯化钡溶液166.6g,恰好完全反应。过滤、干燥后称得沉淀质量为39.4g,则原样品中碳酸钠的质量和最后所得滤液中溶质的质量分数分别为( )
- A.10.6 g 5%
- B.21.2g 5%
- C.10.6 g 10%
- D.21.2 g 10%
答案
正确答案:B
知识点:化学反应方程式的计算
Na2CO3和BaCl2能发生反应生成BaCO3沉淀:BaCl2+ Na2CO3=BaCO3↓+ 2NaCl,题目中给出了“恰好完全反应”,则可通过BaCO3沉淀的质量求出Na2CO3的质量。由恰好完全反应可知,反应后滤液中的溶质只有NaCl一种,要求NaCl的质量分数,需要求出NaCl的质量和滤液的质量。
NaCl的质量可分为两部分,一部分为原来样品中的NaCl,另一部分为反应生成的NaCl。原来样品中的NaCl可通过总质量减去Na2CO3的质量求得,反应生成的NaCl可通过沉淀的质量求出。
滤液的质量=纯碱样品质量22.8 g+350 g水+ BaCl2溶液质量166.6 g-BaCO3沉淀质量39.4 g=500 g。
设原样品中Na2CO3的质量为x,反应生成NaCl的质量为y,则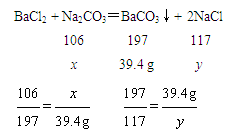
解得:x=21.2 gy=23.4 g。
则原样品中Na2CO3的质量为21.2 g,原样品中NaCl的质量=22.8 g-21.2 g=1.6 g。
则最后所得滤液中NaCl的质量=1.6 g+23.4 g=25.0 g。
所得滤液中NaCl的质量分数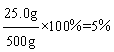 。
。
故选B。
略







