我国早在春秋战国时期,就开始生产和使用铁器。某化学小组到钢铁厂做社会调查,将不同质量的生铁样品(假定其中只含有铁和碳两种单质)分别放入5只烧杯中,各加入等量质量分数相同的稀硫酸进行实验,实验数据见下表:
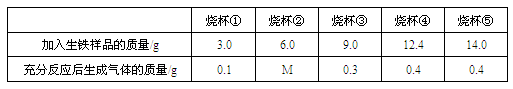
下列说法错误的是( )
- A.表中M的值为0.2
- B.烧杯①②③中的稀硫酸均过量
- C.烧杯④中生铁样品和硫酸恰好完全反应
- D.该生铁样品中铁的质量分数为93.3%
答案
正确答案:C
知识点:化学方程式的计算
A.比较烧杯①和③中的生铁样品的质量及生成气体的质量可知,生成气体的质量
由金属的质量决定,可推断出硫酸过量,且每3.0g生铁样品参加反应能生成0.1g
气体,所以可以判断M的值为0.2,A正确;
B.由A中分析可知,烧杯①②③中的稀硫酸均过量,B正确;
C.由A中分析可知,每3.0g生铁样品参加反应能生成0.1g氢气,可得生成0.4g气体
需要12.0g生铁样品,而烧杯④中提供的生铁样品质量为12.4g,因此推断硫酸反应
完,生铁样品过量,并不是恰好完全反应,C错误;
D.由A中分析可知,每3.0g生铁样品参加反应能生成0.1g氢气,在化学方程式
Fe+H2SO4=FeSO4+H2↑中,由0.1g氢气可计算出参加反应的铁的质量为2.8g,
所以该生铁样品中铁的质量分数为![]() ,D正确;
,D正确;
故选C。
略








