将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。下列判断正确的是( )
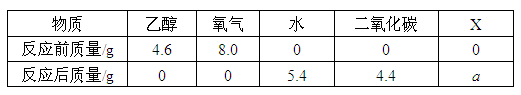
- A.表中a的值为2.6
- B.X一定是该反应的催化剂
- C.X可能含有氢元素
- D.若起始时氧气的质量是9.6g,则无X生成
答案
正确答案:D
知识点:质量守恒定律及其应用
质量守恒定律表格题的一般解题步骤为:①求待测值;②判断反应物和生成物;③结合选项分析。
A.根据质量守恒定律可知:反应前后物质的质量总和相等,则
4.6+8.0+0+0+0=0+0+5.4+4.4+a,求得a=2.8,A错误。
B.根据“反应前后质量减小的是反应物,质量增大的是生成物”,判断出X为生成物,B错误。
C.根据“反应前后质量减小的是反应物,质量增大的是生成物”,判断出乙醇、氧气为反应物,水、二氧化碳、X为生成物,故该反应可表示为乙醇+氧气→水+二氧化碳+X,根据质量守恒定律可知,反应前后元素质量不变,反应前氢元素的质量为乙醇中氢元素的质量即![]() ,生成物水中含有氢元素的质量为
,生成物水中含有氢元素的质量为![]() ,氢元素质量相等,故X中不含氢元素,C错误。
,氢元素质量相等,故X中不含氢元素,C错误。
D.乙醇完全燃烧的化学反应方程式为C2H6O+3O2![]() 2CO2 + 3H2O,即每46份质量的乙醇和96份质量的氧气恰好完全反应生成88份质量的二氧化碳和54份质量的水,各物质按照一定的质量比参加反应,故4.6g乙醇与9.6g氧气恰好完全反应,生成二氧化碳和水,因此若起始时氧气的质量是9.6g,则无X生成,D正确。
2CO2 + 3H2O,即每46份质量的乙醇和96份质量的氧气恰好完全反应生成88份质量的二氧化碳和54份质量的水,各物质按照一定的质量比参加反应,故4.6g乙醇与9.6g氧气恰好完全反应,生成二氧化碳和水,因此若起始时氧气的质量是9.6g,则无X生成,D正确。
故选D。
略








