学习了MnO2对过氧化氢溶液(双氧水)分解有催化作用的知识后,某兴趣小组的同学进行了有关“影响过氧化氢分解速率的因素有哪些”的探究。
[探究一]兴趣小组进行了四个实验,实验数据如表:
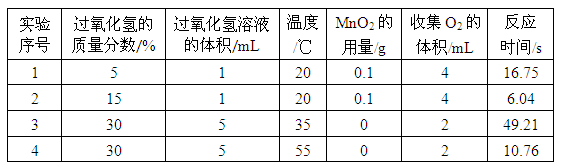
(1)通过实验1和2对比可知,过氧化氢分解速率与____有关;通过实验____和____对比可知,过氧化氢分解速率与温度有关,且温度越高,分解速率越____(填“快”或“慢”)。
(2)用35mL质量分数为30%的过氧化氢溶液制取氧气,为了减小反应速率,加了一定量的水稀释,这会使产生氧气的总质量____(填“减小”、“不变”或“增大”)。
[质疑]CuO能否起到类似MnO2的催化剂作用呢?于是,小组同学又进行了以下探究。
[探究二]猜想一:CuO不是催化剂、也不参与反应,反应前后____和____不变;
猜想二:CuO参与反应产生O2,反应前后____和____改变;
猜想三:CuO是反应的催化剂,反应前后____和____不变。
[实验]用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:
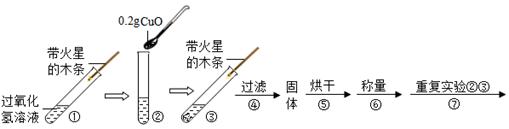
(3)填写如表:

将表中需要填写的内容填写到下列横线上:
(a)____;(b)____;(c)____。
(4)步骤①的目的是与步骤____(可直接填阿拉伯数字)作对比,检验加入氧化铜后过氧化氢的分解速率是否有改变。
(5)步骤④需用到的实验仪器和用品有:铁架台(带铁圈)、漏斗、烧杯、滤纸、____。
答案
过氧化氢的质量分数,3,4,快,不变,质量,化学性质,质量,化学性质,质量,化学性质,复燃,0.2,复燃,③,玻璃棒
知识点:实验探究
(1)通过实验1和2对比可知,两实验中过氧化氢的质量分数不同,其余条件均相同,过氧化氢分解速率不同(即收集相同体积的氧气所用的时间不同),说明过氧化氢分解速率与过氧化氢的质量分数有关。
要说明过氧化氢分解速率与温度有关,需保证温度不同其余条件均不同,观察过氧化氢分解的速率,故需要对比实验3和4,通过对比可知,温度越高,过氧化氢分解速率越快(即收集相同体积的氧气所用时间短)。
(2)生成物只与反应物量的多少有关,与反应物的浓度无关,所以由于改变的只是溶液的浓度,但是溶质的质量没有改变,所以最终产生的氧气的质量不会改变。
[探究二]为探究CuO是否为过氧化氢分解的催化剂,需要验证CuO在化学反应前后的质量和化学性质是否发生改变。若质量和化学性质均未发生改变,则CuO为该反应的催化剂,否则不是。
(3)实验结论为猜想三成立,即CuO为该反应的催化剂,则CuO在反应前后质量和化学性质未改变。
在步骤①中,没有催化剂的条件下过氧化氢分解速率非常慢,故带火星的木条不会复燃。加入催化剂CuO后,过氧化氢分解速率加快,生成氧气能够使带火星的木条复燃,故步骤③中观察到的现象为带火星的木条复燃。由于催化剂在化学反应前后质量不发生变化,步骤②中加入CuO的质量为0.2g,故步骤⑥中CuO的质量仍为0.2g。步骤⑦重复步骤②③,重新加入CuO进行验证,由于催化剂在化学反应前后化学性质不变,故步骤⑦中仍可观察到木条复燃。
(4)步骤①中没有催化剂,过氧化氢分解较慢,木条没有复燃,步骤③中加入催化剂,过氧化氢分解较快,木条复燃,通过①和③的对比可检验加入氧化铜后过氧化氢的分解速率是否有改变。
(5)过滤操作中需要用到的实验仪器和用品有:铁架台(带铁圈)、漏斗、烧杯、滤纸、玻璃棒。其中玻璃棒的作用为引流。
略










