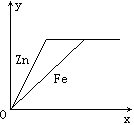
把一定质量的锌和铁分别投入足量的稀硫酸中,充分反应后,生成氢气的质量关系如图所示(用x轴表示反应的时间,用y轴表示生成氢气的质量)。则投入锌与铁的质量比为( )
- A.65:56
- B.56:65
- C.2:3
- D.1:1
答案
正确答案:A
知识点:金属与酸的反应
一定质量的金属与足量的酸反应,产生氢气的质量由金属的量决定。设生成物中金属元素化合价为+a,已知金属的质量为m,金属的相对原子质量为Ar,金属与硫酸反应通式可表示为2R+aH2SO4=R2(SO4)a+aH2↑,则产生氢气的质量为![]() 。
。
由图象可知,Zn和Fe分别与稀硫酸反应最终产生氢气的质量相同,Zn的相对原子质量为65,Fe的相对原子质量为56,Zn、Fe在生成物中的化合价均为+2价,则![]() ,化简得mZn:mFe=65:56。
,化简得mZn:mFe=65:56。
故选A。
略








