老师在课堂上做钠与水反应的实验时,先用小刀切下绿豆大小的一块,可以看到银白色的金属光泽,再放入滴加过几滴酚酞溶液的水中,观察到钠浮在水面上,熔化成闪亮的小球,四处游动,发出“嘶嘶”的响声,溶液变红。反应后产生一种气体,经检验其密度最小且具有可燃性。根据以上描述,回答下列问题:
(1)写出钠的一条物理性质。
(2)写出钠与水反应的化学方程式。
(3)解释钠熔化成闪亮小球的原因。
(4)反应完毕,向溶液中滴加稀盐酸至过量,写出观察到的实验现象。
(5)反应完毕,向溶液中通入CO2,无明显现象。现提供NaOH固体、CO2、乙醇和必需的仪器,并査得如下资料:
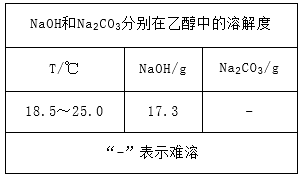
请设计一个“看得见”NaOH与CO2反应的实验,写出操作步骤、现象及结论。
答案
(1)质地柔软,银白色有金属光泽,密度比水小(3分)。
(2)2Na+2H2O![]() 2NaOH+H2↑(5分)。
2NaOH+H2↑(5分)。
(3)钠与水反应放出了大量的热,且钠的熔点不高,所以易熔化成小球(3分)。
(4)观察到的现象是溶液由红色逐渐变为无色(3分)。
(5)将NaOH溶于乙醇形成NaOH的乙醇溶液,向其中通入CO2,看到溶液中有白色晶体析出(Na2CO3),说明NaOH与CO2发生了反应(6分)。
知识点:物理性质和化学性质 化学方程式的书写 实验方案的设计
(1)根据题目中的信息“先用小刀切下绿豆大小的一块,可以看到银白色的金属光泽,再放入滴加过几滴酚酞溶液的水中,观察到钠浮在水面上”可推知钠具有以下物理性质:质地柔软,银白色有金属光泽,密度比水小。
(2)钠与水反应的生成物可使无色酚酞溶液变红,说明生成了呈碱性的物质,反应物中只含有钠、氢、氧三种元素,根据反应前后元素种类守恒,猜测生成了NaOH;反应后还生成了一种气体,且该气体密度最小并具有可燃性,则该气体为H2。因此该反应的化学方程式为2Na+2H2O![]() 2NaOH+H2↑。
2NaOH+H2↑。
(3)钠熔化成闪亮的小球,说明钠与水反应放出了大量的热,且钠的熔点不高,所以易熔化成小球。
(4)反应完毕后得到加有酚酞的NaOH溶液,溶液为红色,向其中滴加稀盐酸至过量,NaOH被逐渐消耗,溶液由碱性逐渐变为酸性,所以观察到的现象是溶液由红色逐渐变为无色。
(5)分析题中资料可知,向NaOH的乙醇溶液中通入CO2,由于生成的Na2CO3在乙醇中难溶,所以会以晶体的形式析出,由此可设计一个“看得见”NaOH与CO2反应的实验如下:将NaOH溶于乙醇形成NaOH的乙醇溶液,向其中通入CO2,看到溶液中有白色晶体析出(Na2CO3),说明NaOH与CO2发生了反应。
略








