可燃物燃烧必须同时具备:①与氧气接触;②温度达到可燃物的着火点两个条件。只要破坏一个条件,就能达到灭火的目的。小明用如图所示的装置进行蜡烛燃烧实验时,发现了一个奇怪的现象:燃着的小蜡烛一会儿就熄灭了,当他将分液漏斗中的水向集气瓶中注入少量时,铝盒中的白磷却立即燃烧起来。
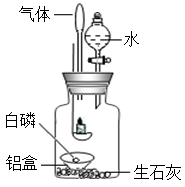
实验反思1:小蜡烛为什么会熄灭?
表达与交流:针对上述实验事实和课本中对燃烧的描述,你对可燃物燃烧条件更深的一点认识是: 。
实验反思2:该实验中,生石灰的主要作用是 。
实验反思3:实验结束后,集气瓶底部的固体中除未反应完的氧化钙外,还含有哪些成分?
交流分析:可能还含有氢氧化钙、碳酸钙(假设白烟全部留在气球中)。
实验方案:取样品加入试管中,加水振荡、静置,有不溶物;上层清液中滴入酚酞溶液,溶液变红,则固体中含有氢氧化钙、碳酸钙。
大家讨论后认为此方案不严密,不能确定固体中一定含有氢氧化钙的原因是: (用化学方程式回答)。要证明含有碳酸钙还需加入一种试剂,反应的化学方程式为 ,能观察到的现象是 。
拓展与应用:只要将分液漏斗换为注射器,该装置还可用于 (填实验名称)。
答案
实验反思1:燃烧需要足够的氧气(5分)。
实验反思2:生石灰与水反应放出大量的热,使白磷达到着火点而燃烧(5分)。
实验方案:CaO+H2O![]() Ca(OH)2(5分),CaCO3+2HCl
Ca(OH)2(5分),CaCO3+2HCl![]() CaCl2+H2O+CO2↑(5分),有气泡产生(3分)。
CaCl2+H2O+CO2↑(5分),有气泡产生(3分)。
拓展与应用:测定空气中氧气含量的实验(5分)。
实验反思1:燃着的小蜡烛一会儿就熄灭了,但小明将分液漏斗中的水向集气瓶中注入少量时,铝盒中的白磷却依然能燃烧,说明装置内是有氧气的,因此可以猜测当氧气存在但氧气的量不足时,燃烧也不会进行。
实验反思2:铝盒中的白磷要想燃烧,温度必须达到白磷的着火点,而生石灰与水反应放出大量的热,可使白磷达到着火点而燃烧。
实验方案:由于集气瓶底部的固体中含有未反应完的氧化钙,所以加水之后氧化钙会与水反应生成氢氧化钙,化学方程式为CaO+H2O![]() Ca(OH)2,因此不能确定使酚酞溶液变红的氢氧化钙是底部固体中本来就有的,还是由氧化钙与水反应生成的。要证明固体中含有碳酸钙可以加入稀盐酸,若看到有气泡产生,则说明有碳酸钙,化学方程式为CaCO3+2HCl
Ca(OH)2,因此不能确定使酚酞溶液变红的氢氧化钙是底部固体中本来就有的,还是由氧化钙与水反应生成的。要证明固体中含有碳酸钙可以加入稀盐酸,若看到有气泡产生,则说明有碳酸钙,化学方程式为CaCO3+2HCl![]() CaCl2+H2O+CO2↑。
CaCl2+H2O+CO2↑。
拓展与应用:本实验研究的是物质燃烧的条件,燃烧会消耗氧气,所以将分液漏斗换为注射器之后,该装置还可用于测定空气中氧气含量的实验
略








