课本上测量空气中氧气体积分数的实验装置存在不少的缺点,如污染环境、误差较大等。小明同学在老师指导下,利用铁锈蚀原理测量空气中氧气的体积分数。
[查阅资料]脱氧剂的主要成分为铁粉、少许活性炭、少量氯化钠和水。活性炭是一种载体,可以使脱氧剂中各组分混合均匀,并使铁粉疏松、透气。
[实验原理]铁生锈消耗集气瓶中的____(填物质名称),生成固态的铁锈,使集气瓶内压强____(填“增大”或“减小”),在压强差的作用下,量筒内水进入集气瓶;氯化钠可以加快铁锈蚀的速率。
[实验过程](1)取一个集气瓶,其实际容积是150mL,取一个量筒,内盛100mL的水。
(2)室温时,将一定量的脱氧剂悬吊在橡皮塞上,再将橡皮塞旋紧到集气瓶口,然后将导气管插入量筒内(如图所示),观察现象。
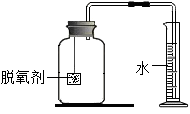
(3)当量筒内水面高度不再变化,且温度恢复至室温时,读出水面在73mL刻度处。
[实验结果]由上述实验数据可以算出,空气中氧气的体积分数是____%。
[反思拓展]本实验的测量结果与理论值不一致,原因可能是____(填字母序号)。
A.使用了足量的脱氧剂
B.脱氧剂中有部分铁粉在实验前已被氧化
C.脱氧剂中的内层的铁粉没有与氧气接触
答案
氧气,减小,18,BC
知识点:实验探究
[实验原理]该实验的原理是铁生锈消耗集气瓶中的氧气,生成固态的铁锈,使集气瓶内压强减小,在压强差的作用下,量筒内水进入集气瓶,进入集气瓶内水的体积即为消耗的氧气的体积,通过进入水的量来判断确定空气中的氧气含量。
[实验结果]根据本实验的原理可知,进入集气瓶内水的体积即为消耗的氧气的体积。量筒内原有100mL水,温度恢复至室温后水面在73mL刻度处,说明进入水的体积为100mL-73mL =27mL,即消耗氧气的体积为27mL,集气瓶的容积为150mL,故氧气的体积分数为![]() 。
。
[反思拓展]由实验结果可知,本实验的测量结果小于理论值,原因可能是B或C。若脱氧剂有部分在实验前已被氧化或者是内层的铁粉没有与氧气接触,都可能造成集气瓶内的氧气没有被充分反应完,使最终测量的结果偏小。
略








