在实验探究课上,老师给同学们一包红色粉末,该粉末是铜粉和氧化铁粉末中的一种或两种。同学们为确定该粉末的成分,进行如下探究。请回答下列问题。
[查阅资料]金属氧化物能够溶于稀酸;铜不溶于稀酸。
[提出问题]红色粉末成分是什么?
[猜想假设]
猜想1:红色粉末是____(填物质名称);
猜想2:红色粉末是氧化铁;
猜想3:红色粉末是铜和____(填物质名称)的混合物。
[设计方案]取少量红色粉末放入硬质玻璃管中,____(填字母序号),充分反应并观察现象(实验装置如图所示)。
A.先通入一段时间的一氧化碳,然后再点燃酒精灯加热
B.先点燃酒精灯加热一段时间,然后再通入一氧化碳
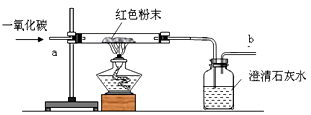
请你完成下表:

将表中需要填写的内容填写到下列横线上:
①____;②____;③____;④____;⑤____。
[实验结论]同学们进行了实验并经过分析,确认猜想3成立。
[反思评价]请你用另一种反应原理证明猜想3成立,实验方案是取少量红色粉末于试管中,加入足量的____充分反应,试管底部有____色固体剩余,溶液变为黄色,则猜想3成立。
答案
铜,氧化铁,A,1,黑,2,黑,3,稀盐酸,红
知识点:实验探究
[猜想假设]由猜想2和猜想3可知,猜想1为红色粉末是铜,猜想3为红色粉末是铜和氧化铁的混合物。
[设计方案]由于一氧化碳具有可燃性,与空气混合点燃可能发生爆炸,因此应先通一段时间的一氧化碳,待玻璃管内气体为纯净的一氧化碳时再进行加热,防止形成混合气体而引起爆炸。
若红色粉末全是铜,则通入一氧化碳后无明显现象,硬质玻璃管中仍然为铜,故现象为红色粉末不变色。
若红色粉末全是氧化铁,则通入一氧化碳后氧化铁被还原为铁,硬质玻璃管中剩余的全部为铁,故现象为红色粉末全部变为黑色。
若红色粉末为铜和氧化铁的混合物,则通过一氧化碳后氧化铜被还原为铁,硬质试管中剩余的是铜和铁的混合物,故现象为红色粉末部分变为黑色。
[反思评价]若要证明猜想3成立,则需证明红色粉末为铜和氧化铁的混合物。由[查阅资料]可知,金属氧化物可溶于稀酸,而铜不溶于稀酸,故可向红色粉末中加入稀酸(我们学习过的稀盐酸、稀硫酸均可),若不溶解则为铜,若全部溶解则为氧化铁,若部分溶解则为铜和氧化铁的混合物。若猜想3成立,则红色粉末部分溶解,铜不溶于稀酸则存在于试管底部,故现象为试管底部有红色固体剩余。
略









